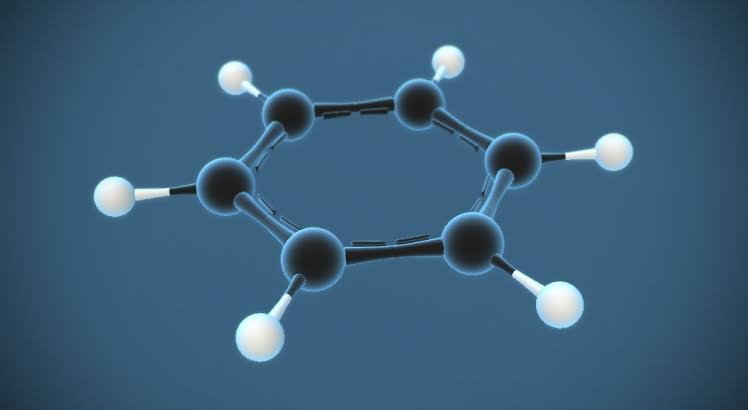
O benzeno é um composto químico orgânico com a fórmula química C6H6. A molécula de benzeno é composta por seis átomos de carbono unidos num anel com um átomo de hidrogénio ligado a cada um deles. Como contém apenas átomos de carbono e de hidrogénio, o benzeno é classificado como um hidrocarboneto.
O benzeno é um constituinte natural do petróleo bruto e é um dos petroquímicos elementares. Devido à ligação pi cíclica contínua entre os átomos de carbono, o benzeno é classificado como um hidrocarboneto aromático, o segundo anuleno. É, por vezes, abreviado PhH. O benzeno é um líquido incolor e altamente inflamável, com um cheiro doce, e é responsável pelo aroma em torno das estações de serviço (de gás). É utilizado principalmente como precursor do fabrico de produtos químicos de estrutura mais complexa, como o etilbenzeno e o cumeno, dos quais são produzidos anualmente milhares de milhões de quilogramas. Dado que o benzeno tem um elevado índice de octanas, os derivados aromáticos, como o tolueno e o xileno, representam normalmente até 25% da gasolina (gasolina). O próprio benzeno tem sido limitado a menos de 1% na gasolina por ser um conhecido carcinógeno humano. A maior parte das aplicações não industriais foram também limitadas pela mesma razão.

A palavra “benzeno” deriva de “goma benzeno” (resina de benjoim), uma resina aromática conhecida pelos farmacêuticos e perfumistas europeus desde o século XV como um produto do sudeste asiático.Um material ácido foi derivado de benzoim por sublimação, e chamado “flores de benzoim”, ou ácido benzóico. O hidrocarboneto derivado do ácido benzóico adquiriu assim o nome benzina, benzol ou benzeno. Michael Faraday primeiro isolou e identificou benzeno em 1825 a partir do resíduo oleoso derivado da produção de gás de iluminação, dando-lhe o nome de bicarbureto de hidrogênio. Em 1833, Eilhard Mitscherlich produziu-o através da destilação do ácido benzóico (da goma benzóico) e da cal. Ele deu ao composto o nome de benzina. Em 1836, o químico francês Auguste Laurent chamou a substância “phène”, palavra que se tornou a raiz da palavra inglesa “phenol”, que é benzeno hidroxilado, e “fenil”, o radical formado pela abstração de um átomo de hidrogênio (radical livre H-) do benzeno.
Em 1845, Charles Mansfield, trabalhando sob August Wilhelm von Hofmann, isolou o benzeno do alcatrão de carvão. Quatro anos depois, Mansfield começou a primeira produção em escala industrial de benzeno, baseada no método do alcatrão de carvão. Gradualmente, o senso desenvolvido entre os químicos de que uma série de substâncias estavam quimicamente relacionadas ao benzeno, compreendendo uma família química diversificada. Em 1855, Hofmann usou a palavra “aromático” para designar essa relação familiar, após uma propriedade característica de muitos de seus membros. Em 1997, o benzeno foi detectado no espaço profundo.
A fórmula empírica para o benzeno foi muito tempo conhecido, mas a sua estrutura altamente polinsaturada, com apenas um átomo de hidrogênio para cada átomo de carbono, foi um desafio para determinar. Archibald Scott Couper em 1858 e Joseph Loschmidt em 1861 sugeriram estruturas possíveis que continham múltiplas ligações duplas ou múltiplos anéis, mas muito pouca evidência estava então disponível para ajudar os químicos a decidir sobre qualquer estrutura particular.

Em 1865, o químico alemão Friedrich August Kekulé publicou um artigo em francês (pois ele estava então ensinando na Bélgica francófona) sugerindo que a estrutura continha um anel de seis átomos de carbono com ligações alternadas simples e duplas. No ano seguinte, ele publicou um artigo muito mais longo em alemão sobre o mesmo assunto. Kekulé usou evidências que se acumularam nos anos seguintes – nomeadamente, que sempre parecia haver apenas um isômero de qualquer monoderivado de benzeno, e que sempre parecia haver exatamente três isômeros de cada derivado destituído – agora compreendido como correspondendo ao orto, meta e para padrões de substituição areno-para argumentar em apoio de sua estrutura proposta. O anel simétrico de Kekulé poderia explicar estes fatos curiosos, assim como a relação 1:1 carbono-hidrogênio do benzeno.
A nova compreensão do benzeno, e portanto de todos os compostos aromáticos, provou ser tão importante para a química pura e aplicada que em 1890 a Sociedade Alemã de Química organizou uma apreciação elaborada em homenagem a Kekulé, celebrando o vigésimo quinto aniversário de seu primeiro trabalho sobre benzeno. Aqui Kekulé falou da criação da teoria. Ele disse que tinha descoberto a forma de anel da molécula de benzeno depois de ter um sonho ou alucinação de uma cobra engolindo sua própria cauda (este é um símbolo comum em muitas culturas antigas conhecidas como Ouroboros ou nó sem fim). Esta visão, disse ele, veio até ele após anos de estudo da natureza das ligações carbono-carbono. Isto foi 7 anos depois de ele ter resolvido o problema de como os átomos de carbono poderiam se ligar a até outros quatro átomos ao mesmo tempo.
Curiosamente, uma descrição humorística semelhante do benzeno tinha aparecido em 1886 num panfleto intitulado Berichte der Durstigen Chemischen Gesellschaft (Journal of the Thirsty Chemical Society), uma paródia da Berichte der Deutschen Chemischen Gesellschaft, apenas a paródia tinha macacos agarrados uns aos outros num círculo, em vez de cobras como na anedota de Kekulé. Alguns historiadores sugeriram que a paródia era uma colher de sopa da anedota da cobra, possivelmente já bem conhecida por transmissão oral mesmo que ainda não tivesse aparecido na imprensa. O discurso de Kekulé de 1890 em que esta anedota apareceu foi traduzido para inglês. Se a anedota é a memória de um acontecimento real, as circunstâncias mencionadas na história sugerem que ela deve ter acontecido no início de 1862. A natureza cíclica do benzeno foi finalmente confirmada pela cristalizadora Kathleen Lonsdale em 1929.
Nos séculos XIX e início do século XX, o benzeno foi utilizado como loção pós-barba devido ao seu agradável cheiro. Antes da década de 1920, o benzeno era frequentemente utilizado como solvente industrial, especialmente para desengordurar metais. Como sua toxicidade tornou-se óbvia, o benzeno foi suplantado por outros solventes, especialmente o tolueno (metilbenzeno), que tem propriedades físicas semelhantes, mas não é tão cancerígeno.
Em 1903, Ludwig Roselius popularizou o uso do benzeno para descafeinar o café. Esta descoberta levou à produção de Sanka. Este processo foi posteriormente descontinuado. Benzeno foi historicamente usado como um componente significativo em muitos produtos de consumo, tais como Liquid Wrench, vários removedores de tinta, cimentos de borracha, removedores de manchas, e outros produtos. A fabricação de algumas dessas formulações contendo benzeno cessou por volta de 1950, embora a Liquid Wrench tenha continuado a conter quantidades significativas de benzeno até o final da década de 1970.
Encontram-se vestígios de benzeno no petróleo e no carvão. É um subproduto da combustão incompleta de muitos materiais. Para uso comercial, até à Segunda Guerra Mundial, a maior parte do benzeno era obtido como subproduto da produção de coque (ou “óleo leve de forno de coque”) para a indústria siderúrgica. Entretanto, na década de 1950, o aumento da demanda por benzeno, especialmente por parte da crescente indústria de polímeros, exigiu a produção de benzeno a partir do petróleo. Atualmente, a maior parte do benzeno provém da indústria petroquímica, sendo apenas uma pequena fracção produzida a partir do carvão.

A difração de raios X mostra que todas as seis ligações carbono-carbono no benzeno têm o mesmo comprimento, a 140 picómetros (pm)[citação necessária]. Os comprimentos dos títulos C-C são maiores do que um título duplo (135 pm), mas menores do que um título simples (147 pm). Essa distância intermediária é consistente com a deslocalização dos elétrons: os elétrons para a ligação C-C são distribuídos igualmente entre cada um dos seis átomos de carbono. O benzeno tem 6 átomos de hidrogênio – menos do que o alcano correspondente, o hexano.
A molécula é plana. A descrição orbital molecular envolve a formação de três orbitais deslocalizados que abrangem todos os seis átomos de carbono, enquanto a descrição da ligação de valência envolve uma superposição de estruturas de ressonância. É provável que esta estabilidade contribua para as propriedades moleculares e químicas peculiares conhecidas como aromaticidade. Para refletir com precisão a natureza da ligação, o benzeno é freqüentemente representado com um círculo dentro de um arranjo hexagonal de átomos de carbono.
Derivados de benzeno ocorrem suficientemente frequentemente como um componente de moléculas orgânicas que o Unicode Consortium alocou um símbolo no bloco Miscelânea Técnica com o código U+232C (⌬) para representá-lo com três ligações duplas, e U+23E3 (⏣) para uma versão delocalizada.
Muitos compostos químicos importantes são derivados do benzeno, substituindo um ou mais dos seus átomos de hidrogénio por outro grupo funcional. Exemplos de derivados simples de benzeno são fenol, tolueno e anilina, PhOH abreviado, PhMe e PhNH2, respectivamente. Ligando anéis de benzeno dá bifenil, C6H5-C6H5. Mais perdas de hidrogênio dão hidrocarbonetos aromáticos “fundidos”, como naftaleno, antraceno, fenantreno e pireno. O limite do processo de fusão é o alotropo livre de hidrogênio de carbono, grafite.

Nos heterócitos, os átomos de carbono no anel de benzeno são substituídos por outros elementos. As variações mais importantes contêm azoto. A substituição de um CH por N dá o composto piridina, C5H5N. Embora o benzeno e a piridina estejam estruturalmente relacionados, o benzeno não pode ser convertido em piridina. A substituição de uma segunda ligação de CH por N dá, dependendo da localização do segundo N, piridazina, pirimidina e pirazina.
Quatro processos químicos contribuem para a produção industrial de benzeno: reforma catalítica, hidrodealquilação de tolueno, desproporção de tolueno e steam cracking. De acordo com o Perfil Toxicológico ATSDR para o benzeno, entre 1978 e 1981, os reformados catalíticos representaram aproximadamente 44-50% da produção total de benzeno dos EUA.
Reforma catalítica
Na reforma catalítica, mistura-se uma mistura de hidrocarbonetos com pontos de ebulição entre 60-200 °C com hidrogênio gasoso e expõe-se a um catalisador bifuncional de cloreto de platina ou de cloreto de rénio a 500-525 °C e a pressões compreendidas entre 8-50 atm. Nestas condições, os hidrocarbonetos alifáticos formam anéis e perdem hidrogênio para se tornarem hidrocarbonetos aromáticos. Os produtos aromáticos da reação são então separados da mistura reacional (ou reformado) por extração com qualquer um de vários solventes, incluindo dietilenoglicol ou sulfolano, e o benzeno é então separado dos outros aromáticos por destilação. A etapa de extração dos aromáticos do reformado é projetada para produzir aromáticos com componentes não aromáticos mais baixos. A recuperação dos aromáticos, comumente chamados de BTX (isômeros de benzeno, tolueno e xileno), envolve tais etapas de extração e destilação. Há um bom número de processos licenciados disponíveis para extração de aromáticos. De forma semelhante a este reforma catalítico, a UOP e a BP comercializaram um método de GPL (principalmente propano e butano) a aromáticos.

Hidrodealquilação de tolueno
A hidrodessalquilação de tolueno converte o tolueno em benzeno. Neste processo intensivo em hidrogênio, o tolueno é misturado com hidrogénio e, em seguida, passado por um catalisador de crómio, molibdénio ou óxido de platina a 500-600 °C e a uma pressão de 40-60 atm. Por vezes, utilizam-se temperaturas mais elevadas em vez de um catalisador (em condições de reação semelhantes). Sob estas condições, o tolueno sofre desalquilação com benzeno e metano:
C6H5CH3 + H2 → C6H6 + CH4
Esta reacção irreversível é acompanhada de uma reação lateral de equilíbrio que produz bifenilo (também conhecido por difenilo) a temperaturas mais elevadas:
2C6H6 ⇌ H2 + C6H5–C6H5
Se a corrente de matérias-primas contiver muitos componentes não aromáticos (parafinas ou naftenos), estes são provavelmente decompostos em hidrocarbonetos inferiores, como o metano, o que aumenta o consumo de hidrogênio.
Um rendimento de reação típico é superior a 95%. Às vezes, xilenos e aromáticos mais pesados são usados no lugar do tolueno, com eficiência semelhante.
Isso é frequentemente chamado de metodologia “on-purpose” para produzir benzeno, em comparação com os processos convencionais de extração BTX (benzeno-tolueno-xileno).

Desproporção de tolueno
Quando um complexo químico tem demandas similares para benzeno e xileno, a desproporção do tolueno (TDP) pode ser uma alternativa atraente à hidrodessalquilação do tolueno. Em sentido amplo, duas moléculas de tolueno são reagidas e os grupos metilitários rearranjados de uma molécula de tolueno para outra, produzindo uma molécula de benzeno e uma molécula de xileno.
Dado que a procura de para-xileno (p-xileno) excede substancialmente a procura de outros isomeros de xileno, pode ser utilizado um refinamento do processo TDP denominado Selective TDP (STDP). Neste processo, o fluxo de xileno que sai da unidade de TDP é de aproximadamente 90% de paraxileno. Em alguns sistemas catalíticos atuais, mesmo a relação benzeno/xilenos diminui (mais xilenos) quando a demanda de xilenos é maior.
Craqueamento a vapor
O craqueamento a vapor é o processo de produção de etileno e outros alcenos a partir de hidrocarbonetos alifáticos. Dependendo da matéria-prima usada para produzir as olefinas, o craqueamento a vapor pode produzir um subproduto líquido rico em benzeno chamado gasolina de pirólise. A gasolina de pirólise pode ser misturada com outros hidrocarbonetos como aditivo da gasolina, ou encaminhada através de um processo de extração para recuperar os aromáticos BTX (benzeno, tolueno e xilenos).

Quais são os usos do benzeno?
O benzeno é utilizado principalmente como produto intermédio na fabricação de outros produtos químicos, sobretudo de etilbenzeno, cumeno, ciclo-hexano, nitrobenzeno e alquilbenzeno. Mais de metade de toda a produção de benzeno é transformada em etilbenzeno, um precursor do estireno, que é utilizado para fabricar polímeros e plásticos como poliestireno e EPS. Cerca de 20% da produção de benzeno é usada para fabricar cumeno, que é necessário para produzir fenol e acetona para resinas e adesivos.
O ciclohexano consome cerca de 10% da produção mundial de benzeno; é usado principalmente na fabricação de fibras de nylon, que são processadas em têxteis e plásticos de engenharia. Quantidades menores de benzeno são usadas para fazer alguns tipos de borrachas, lubrificantes, corantes, detergentes, drogas, explosivos e pesticidas. Em 2013, o maior país consumidor de benzeno foi a China, seguida pelos EUA. A produção de benzeno está atualmente em expansão no Médio Oriente e em África, enquanto as capacidades de produção na Europa Ocidental e na América do Norte estão a estagnar.
O tolueno é agora frequentemente utilizado como substituto do benzeno, por exemplo, como aditivo de combustível. As propriedades dos dois solventes são semelhantes, mas o tolueno é menos tóxico e tem uma faixa de líquidos mais ampla. O tolueno é também transformado em benzeno.

Quais são os efeitos do benzeno na saúde?
O benzeno é classificado como cancerígeno, o que aumenta o risco de cancro e outras doenças, e é também uma causa notória de falência da medula óssea. Quantidades substanciais de dados epidemiológicos, clínicos e laboratoriais ligam o benzeno à anemia aplástica, leucemia aguda, anomalias da medula óssea e doenças cardiovasculares.58][59][60] As neoplasias hematológicas específicas a que o benzeno está associado incluem: leucemia mieloide aguda (LMA), anemia aplástica, síndrome mielodisplásica (SMD), leucemia linfoblástica aguda (LLA) e leucemia mieloide crônica (LMC).
O American Petroleum Institute (API) declarou em 1948 que “é geralmente considerado que a única concentração absolutamente segura para o benzeno é zero”. Não há nível de exposição seguro; mesmo pequenas quantidades podem causar danos. O Departamento de Saúde e Serviços Humanos dos EUA (DHHS) classifica o benzeno como um carcinógeno humano. A exposição prolongada a níveis excessivos de benzeno no ar causa leucemia, um câncer potencialmente fatal dos órgãos formadores de sangue.
Como o benzeno é onipresente na gasolina e nos combustíveis de hidrocarbonetos que estão em uso em todos os lugares, a exposição humana ao benzeno é um problema de saúde global. O benzeno tem como alvo o fígado, rim, pulmão, coração e cérebro e pode causar quebras de cadeias de DNA, danos cromossômicos, etc. O benzeno provoca cancro nos animais, incluindo nos seres humanos. O benzeno tem demonstrado causar cancro em ambos os sexos de várias espécies de animais de laboratório expostos através de várias vias.

