O planeta está aquecendo. Tanto a terra como os oceanos estão mais quentes agora do que os registos que começaram em 1880, e as temperaturas ainda continuam a subir. Este aumento de temperatura, em poucas palavras, é o aquecimento global.
A temperatura média da superfície subiu um total de 1,71 graus Fahrenheit (0,95 graus Celsius) entre 1880 e 2016. O ritmo de mudança tem sido de 0,13 graus F (0,07 graus C) por década, com o aquecimento da superfície terrestre mais rápido que a superfície oceânica – 0,18 graus F (0,10 graus C) versus 0,11 graus F (0,06 graus C) por década, respectivamente.
O Acordo de Paris, ratificado por 159 nações a partir do verão de 2017, visa deter esse aquecimento a 2,7 graus F (1,5 graus C) acima da temperatura média da Terra durante a época pré-industrial – um objetivo que a maioria dos cientistas e formuladores de políticas concordam que será um desafio a ser cumprido. (Os Estados Unidos participaram na elaboração desse tratado não vinculativo sob a presidência de Barack Obama, mas o presidente Donald Trump disse que sua administração não participará). Eis como a humanidade conseguiu aquecer o planeta.

O principal motor do aquecimento de hoje é a combustão de combustíveis fósseis. Estes hidrocarbonetos aquecem o planeta através do efeito estufa, que é causado pela interação entre a atmosfera da Terra e a radiação solar que chega. A física básica do efeito estufa foi descoberta há mais de cem anos por um cara inteligente usando apenas lápis e papel, segundo Josef Werne, professor de geologia e ciência ambiental da Universidade de Pittsburgh, ao Live Science.
Esse “cara esperto” foi Svante Arrhenius, um cientista sueco e eventual ganhador do Prêmio Nobel. Simplificando, a radiação solar atinge a superfície da Terra e, em seguida, salta de volta para a atmosfera como calor. Os gases na atmosfera prendem esse calor, impedindo que ele escape para o vazio do espaço (boas notícias para a vida no planeta). Em um trabalho apresentado em 1895, Arrhenius descobriu que gases de efeito estufa como o dióxido de carbono poderiam aprisionar o calor perto da superfície da Terra – e que pequenas mudanças na quantidade desses gases poderiam fazer uma grande diferença na quantidade de calor aprisionado.
Desde o início da revolução industrial, os seres humanos têm vindo a alterar rapidamente o equilíbrio dos gases na atmosfera. A queima de combustíveis fósseis como carvão e petróleo liberta vapor de água, dióxido de carbono (CO2), metano (CH4), ozono e óxido nitroso (N2O) – os principais gases com efeito de estufa. O dióxido de carbono é o gás com efeito de estufa mais comum. Entre cerca de 800.000 anos atrás e o início da Revolução Industrial, sua presença na atmosfera era de cerca de 280 partes por milhão (ppm). Hoje, é de cerca de 400 ppm. (Este número significa que há 400 moléculas de dióxido de carbono no ar por cada milhão de moléculas de ar).
Os níveis de CO2 não têm sido tão altos desde a época do Plioceno, que ocorreu entre 3 milhões e 5 milhões de anos atrás, de acordo com a Scripps Institution of Oceanography.

O CO2 entra na atmosfera por uma variedade de rotas. A queima de combustíveis fósseis libera CO2 e é de longe a principal forma de aquecimento do planeta pelas emissões americanas. De acordo com o relatório 2015 da EPA, a queima de combustíveis fósseis nos EUA, incluindo a geração de eletricidade, libera anualmente pouco mais de 5,5 bilhões de toneladas (5 bilhões de toneladas métricas) de CO2 para a atmosfera. Outros processos – como o uso não energético de combustíveis, a produção de ferro e aço, a produção de cimento e a incineração de resíduos – impulsionam a emissão total anual de CO2 nos EUA para quase 6 bilhões de toneladas (5,5 bilhões de toneladas métricas).
O desmatamento também é um grande contribuinte para o excesso de CO2 na atmosfera. Na verdade, o desmatamento é a segunda maior fonte antropogênica (de origem humana) de dióxido de carbono, segundo pesquisa publicada pela Universidade Duke. Quando as árvores são mortas, elas liberam o carbono que armazenaram durante a fotossíntese. De acordo com o Global Forest Resources Assessment 2010, o desmatamento libera quase um bilhão de toneladas de carbono para a atmosfera por ano.
O metano é o segundo gás de efeito estufa mais comum, mas é muito mais eficiente na captura de calor. Em 2012, o gás foi responsável por cerca de 9% de todas as emissões de gases de efeito estufa nos EUA, de acordo com a EPA. A EPA informa que o metano tem um impacto 20 vezes maior do que o dióxido de carbono nas mudanças climáticas durante um período de 100 anos.
O metano pode vir de muitas fontes naturais, mas os seres humanos causam uma grande parte das emissões de metano através da mineração, do uso do gás natural, da criação em massa de gado e do uso de aterros sanitários, de acordo com o Inventário de Emissões de Gases de Efeito Estufa dos EUA e o relatório Sinks de 1990 a 2012. Na verdade, segundo a EPA, os seres humanos são responsáveis por mais de 60 por cento das emissões de metano.

Quais são os efeitos do aquecimento global?
Aquecimento global não significa apenas aquecimento – e é por isso que “mudança climática” se tornou o termo tendência entre pesquisadores e formuladores de políticas. Enquanto o globo está se tornando mais quente em média, este aumento de temperatura pode ter efeitos paradoxais, como tempestades de neve mais graves. Há várias grandes formas de as mudanças climáticas poderem e afetarem o globo: derretendo o gelo, secando áreas já áridas, causando extremos climáticos e perturbando o delicado equilíbrio dos oceanos.
Talvez o efeito mais visível das mudanças climáticas até agora seja o derretimento das geleiras e do gelo marinho. Os lençóis de gelo têm recuado desde o fim da última Era Glacial há cerca de 11.700 anos, mas o aquecimento do último século acelerou o seu desaparecimento. Um estudo de 2016 concluiu que há 99% de chance de que o aquecimento global tenha causado o recente recuo das geleiras; na verdade, a pesquisa mostrou que esses rios de gelo recuaram 10 a 15 vezes a distância que teriam se o clima tivesse se mantido estável. O Parque Nacional Glaciar em Montana tinha 150 glaciares no final do século XIX. Hoje tem 26. A perda de geleiras pode causar a perda de vidas humanas quando represas geladas que retêm lagos glaciares se desestabilizam e rebentam, ou quando avalanches causadas por vilas instáveis de gelo enterram aldeias.

No Pólo Norte, o aquecimento avança duas vezes mais rapidamente do que nas latitudes médias, e o gelo marinho mostra a tensão. A queda e o gelo de inverno no Ártico atingiram recordes de baixas tanto em 2015 como em 2016, o que significa que a extensão de gelo não cobriu tanto do mar aberto como anteriormente observado. Segundo a NASA, as 13 menores extensões máximas de gelo marinho no Ártico aconteceram nos últimos 13 anos. O gelo também se forma mais tarde na estação e derrete mais facilmente na primavera. Alguns cientistas pensam que o Oceano Árctico verá verões sem gelo dentro de 20 ou 30 anos.
Na Antártida, o quadro tem sido um pouco menos claro. A Península Antártica Ocidental está aquecendo mais rápido do que qualquer outro lugar além de algumas partes do Ártico, de acordo com a Antártica e a Coligação do Oceano Sul. A península é onde a plataforma de gelo de Larsen C acabou de se rasgar em julho de 2017, desovando um iceberg do tamanho de Delaware. O gelo marinho ao largo da Antártida é muito variável, no entanto, e algumas áreas atingiram níveis recorde nos últimos anos – embora esses níveis recordes possam ter as impressões digitais das alterações climáticas, uma vez que podem resultar da deslocação do gelo terrestre para o mar à medida que as geleiras derretem, ou de alterações relacionadas com o aquecimento do vento. Em 2017, no entanto, este padrão de gelo recorde se inverteu abruptamente, com um recorde baixo. Em 3 de março de 2017, o gelo marinho antártico foi medido em uma extensão de 71.000 milhas quadradas (184.000 quilômetros quadrados) a menos do que o mínimo anterior de 1997.
Planeta mais quente e mais seco
O aquecimento global vai mudar as coisas entre os pólos, também. Espera-se que muitas áreas já secas se tornem ainda mais secas à medida que o mundo aquece. O sudoeste e as planícies centrais dos Estados Unidos, por exemplo, devem passar por décadas de “megadutos” mais duros do que qualquer outra coisa na memória humana.
“O futuro da seca no oeste da América do Norte provavelmente será pior do que qualquer pessoa já experimentou na história dos Estados Unidos”, disse Benjamin Cook, cientista climático do Instituto Goddard de Estudos Espaciais da NASA, em Nova York, que publicou pesquisas projetando essas secas em 2015, ao Live Science. “Estas são secas que estão tão além da nossa experiência contemporânea que são quase impossíveis de se pensar”.

O estudo previu uma probabilidade de 85 por cento de secas que durariam pelo menos 35 anos na região até 2100. O principal impulsionador, segundo os pesquisadores, é a evaporação crescente da água dos solos mais quentes e quentes. Grande parte da precipitação que cai nestas regiões áridas será perdida.
Enquanto isso, a pesquisa de 2014 descobriu que muitas áreas provavelmente verão menos chuvas à medida que o clima aquecer. As regiões subtropicais, incluindo o Mediterrâneo, a Amazônia, a América Central e a Indonésia serão provavelmente as mais atingidas, que o estudo encontrou, enquanto a África do Sul, o México, a Austrália Ocidental e a Califórnia também vão secar.
Outro impacto do aquecimento global: o clima extremo. Espera-se que os furacões e tufões se tornem mais intensos à medida que o planeta aquece. Os oceanos mais quentes evaporam mais umidade, que é o motor que alimenta estas tempestades. O Painel Internacional sobre Mudanças Climáticas (IPCC) prevê que mesmo que o planeta diversifique suas fontes de energia e transições para uma economia menos intensa em combustíveis fósseis (conhecido como cenário A1B), os ciclones tropicais provavelmente serão até 11% mais intensos, em média. Isso significa mais danos causados pelo vento e pela água em costas vulneráveis. (O IPCC é uma organização internacional criada pelas Nações Unidas para informar sobre o estado da ciência das mudanças climáticas e fornecer as melhores projeções de impactos climáticos e estratégias de adaptação às projeções).
Paradoxalmente, as mudanças climáticas também podem causar tempestades de neve mais extremas. De acordo com os Centros Nacionais de Informação Ambiental, as tempestades de neve extremas no leste dos Estados Unidos se tornaram duas vezes mais comuns desde o início dos anos 1900. Novamente, o aquecimento da temperatura dos oceanos leva a um aumento da evaporação da umidade para a atmosfera. Essa umidade alimenta tempestades que atingem os Estados Unidos continental.

Alguns dos impactos mais imediatos do aquecimento global estão sob as ondas. Os oceanos atuam como um sumidouro de carbono – absorvem o dióxido de carbono dissolvido. Isso não é mau para a atmosfera, mas não é bom para o ecossistema marinho. Quando o dióxido de carbono reage com a água do mar, leva a um declínio no pH, um processo conhecido como acidificação oceânica. O aumento da acidez devora as conchas de carbonato de cálcio e os esqueletos dos quais muitos organismos oceânicos dependem para sobreviver. Estes incluem mariscos, pterópodes e corais, de acordo com a NOAA.
Os corais, em particular, são o canário em uma mina de carvão para as mudanças climáticas nos oceanos. Os cientistas marinhos observaram níveis alarmantes de branqueamento dos corais, eventos em que os corais expulsam as algas simbióticas que lhes fornecem nutrientes e lhes dão as suas cores vivas. O branqueamento ocorre quando os corais estão estressados, e os fatores de estresse podem incluir altas temperaturas. Em 2016 e 2017, a Grande Barreira de Corais da Austrália experimentou eventos de branqueamento costas com costas. Os corais podem sobreviver ao branqueamento, mas eventos de branqueamento repetidos tornam a sobrevivência cada vez menos provável.
Apesar do esmagador consenso científico sobre as causas e a realidade do aquecimento global, a questão é controversa do ponto de vista político. Por exemplo, negadores das mudanças climáticas argumentaram que o aquecimento diminuiu entre 1998 e 2012, um fenômeno conhecido como o “hiato da mudança climática”.
Infelizmente para o planeta, o hiato nunca existiu. Dois estudos, um publicado na revista Science em 2015 e outro publicado em 2017 na revista Science Advances, reanalisaram os dados da temperatura dos oceanos que mostraram o abrandamento do aquecimento e descobriram que, de facto, era uma mera era de medição. Entre os anos 50 e 90, a maioria das medições da temperatura dos oceanos foi feita a bordo de barcos de pesquisa. A água era bombeada para tubulações através da casa de máquinas, que acabavam por aquecer ligeiramente a água.
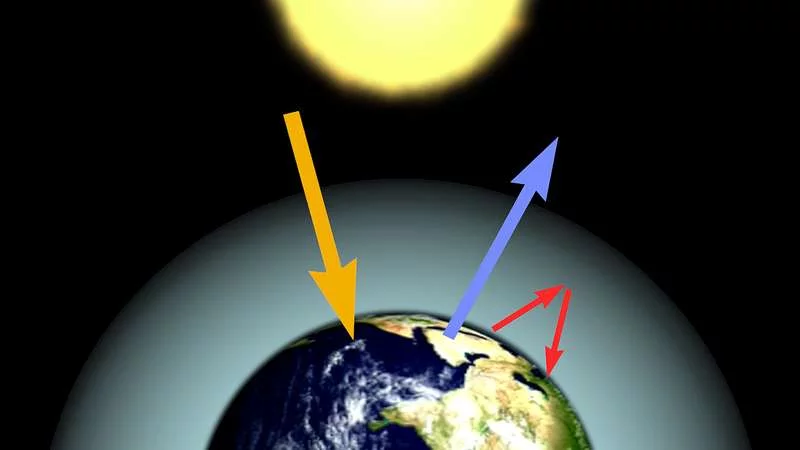
Após os anos 90, os cientistas começaram a usar sistemas baseados em bóias oceânicas, que eram mais precisos, para medir a temperatura do oceano. O problema surgiu porque ninguém corrigiu a mudança nas medições entre os barcos e as bóias. Fazer essas correções mostrou que os oceanos aqueceram 0,22 graus Fahrenheit (0,12 graus Celsius) em média por década desde 2000, quase duas vezes mais rápido que as estimativas anteriores de 0,12 graus F (0,07 graus C) por década.
Um número crescente de líderes empresariais, funcionários governamentais e cidadãos privados estão preocupados com o aquecimento global e suas implicações, e estão propondo medidas para reverter a tendência.
“Enquanto alguns argumentam que ‘a Terra vai se curar’, os processos naturais para remover esse CO2 causado pelo homem da atmosfera funcionam na escala de tempo de centenas de milhares a milhões de anos”, afirmou Werne, da Universidade de Pittsburgh. “Portanto, sim, a Terra se curará, mas não a tempo de nossas instituições culturais serem preservadas como estão”. Portanto, no nosso próprio interesse, devemos agir de uma forma ou de outra para lidar com as mudanças climáticas que estamos causando”.
O esforço mais ambicioso para evitar o aquecimento é o Acordo de Paris. Este tratado internacional não vinculativo entrou em vigor em Novembro de 2016. O objetivo é manter o aquecimento “bem abaixo de 2 graus Celsius acima dos níveis pré-industriais e prosseguir esforços para limitar ainda mais o aumento da temperatura a 1,5 graus Celsius”, de acordo com as Nações Unidas. Cada signatário do tratado concordou em estabelecer seus próprios limites voluntários de emissões e torná-los mais rígidos ao longo do tempo. Para os Estados Unidos sob a presidência de Obama, isso significava limitar as emissões de gases de efeito estufa a menos de 28% dos níveis de 2005 até 2025. Os cientistas climáticos disseram que os limites de emissões sugeridos até agora não manteriam o aquecimento tão baixo quanto 1,5 ou mesmo 2 graus C, mas que seria uma melhoria em relação ao cenário “business-as-usual”.













